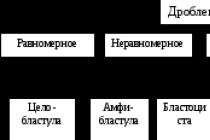
Было оговорено, что на мощности свыше 600 Вт лучше использовать двухуровневое питание, которое позволяет довольно серьезно разгрузить выходной каскад и на меньшем количестве оконечных транзисторов получить большую мощность. Для начала стоит пояснить что же есть такое - двухуровневое питание.
Надеемся не надо пояснять что такое двуполярный источник питания, этот же вариант можно назвать "четырехполярным", поскольку относительно общего провода имеется 4 различных напряжения. Принципиальная схема такого источника приведена на рисунке 1.
Рисунок 1.
Однако напряжение питания необходимо подавать на оконечный каскад усилителя, а как быть, если этих напряжений 2? Правильно - необходима дополнительная схема управления этим самым питанием. По принципу управления различают 2 основных класса - G и H. Отличаютс они между собой прежде всего тем, что класс G изменяет напряжение питания на оконечном каскаде плавно, т.е. силовые транзисторы системы управления питания работают в усилительном режиме, а в классе H силовые ключи системы управления питанием подают ступечато, т.е. они либо полностью закрыты, либо полностью открыты...
Временные диаграммы приведены на рисунке 2 и 3, на рис.2 - класс G, на рис.3 - класс H. Синяя линия - выходной сигнал, красная и зеленая - напряжение питания оконечного каскада усилителя мощности.

Рисунок 2.
Рисунок 3.
Как должно подаваться питание на оконечный каскад вроде разобрались, осталось выяснить каким набором элементов это сделать...
Для начала рассмотрим класс H. На рисунке 5 приведена принципиальная схема усилителя мощности работающег в класе H.

Рисунок 4 УВЕЛИЧИТЬ .
Синим прописано напряжение и мощностьна нагрузку 4 Ома, красны для нагрузки 8 Ом, на рисунке так же показан рекомендуемый источник питания. Как видно из схемы ее костяк состоит из типовго класаа AB, однако питание на усилитель напряжение подается уже с более высоковольной "ветки" питания, причем влияние выходного сигнала на напряжение питания усилителя напряжение снижено (уменьшено сопротивление R36, R37, иногда номинал этих резисторов приходится снижать вплоть до 68 Ом, особенно на мощностях выше 1 кВт), поскольку при подключении "второго этажа" питания на выходном сигнале наблюдается небольшой всплеск, которй ухом уловит не каждый, а вот на устойчивость схемы он влияет довольно серьезно...
Управление питанием, подаваемым на оконечные каскады осуществляется компораторами LM311, порог срабатывания которых регулируется подстроечными резисторами R73 и R77. Для правильной настройки потребуется или ОЧЕНЬ хороший слух или, что предпочтительней - осцилограф.
После компораторов стоят транзисторные драйвера, которые работают уже непосредственно на затворы мосфитов разной структуры. Поскольку силовые мосфиты управления питанием работаю к лючевом режиме, то выделяемое на них тепло довльно низкое, для них гораздо важнее максимальный ток, протекающий по открытому переход сток-исток. Мы используем для этих целей транзисторы IRFP240-IRFP9240 для усилителей до 700 Вт, их же, но уже по 2 в параллель для мощностей до 1 кВт и IRF3710-IRF5210 для мощностей свыше 1 кВт.
На рисунке 5 приведена принципиальная схема усилителя мощности на 1400 Вт класса H. Отличается схема от предыдущего варианта тем, что в оконечном каскаде используется уже 6 пар транзисторов (для усилителя на 1000 Вт необходимо 4 пары), а силовые ключи управления питания IRF3710-IRF5210.

Рисунок 5. УВЕЛИЧИТЬ
На рисунке 6 приведена принципиальная схема усилителя "Хамелеон 600 G", работающий в классе G ну и с выходной мощность до 600 Вт, причем как на нагрузку как 4 Ома, так и 8 Ом. По сути управление "вторым этажом" питания осуществляется повторителями напряжения выходного сигнала, только на них предварительно подается дополнительное опорное напряжени в 18 вольт и как только напряжение на выходе приближается к величине напряжения "первого этажа" более чем на 18 вольт повторители начинаю подавать напряжение со "второго этажа". Плюсом данной схемотехники является то, что остутствуют коммутационные помехи, характерные для класса H, однако улучшение качества звука требует довольно серьезных жертв - количество транзисторов в упрвлении напряжением питания оконечного каскада должно быть равно количеству самих оконечных транзисторов и это будет практически на предел ОБР, т.е. требуется довольно хорошее охлаждение.

Рисунок 6 УВЕЛИЧИТЬ
На рисунке 7 приведена схему усилителя на мощность до 1400 Вт касса G, в которой используется 6 пар как оконечных, так и управляющих транзисторов (для мощностей до 1000 Вт используетс по 4 пары)

Рисунок 7 УВЕЛИЧИТЬ
Чертежи печатных плат - полная версия - лежат . Чертежи в формате lay, в jpg будут несколько позже...
Технические характеристики усилетелей сведены в таблицу:
| Наименование параметра | Значение |
| Напряжение питания, В, двухуровневое не более | |
| Максимальна выходная мощность на нагрузку 4 Ома: УМ ХАМЕЛЕОН 600 H УМ ХАМЕЛЕОН 1000 H УМ ХАМЕЛЕОН 1400 H УМ ХАМЕЛЕОН 600 G УМ ХАМЕЛЕОН 1000 G | |
| Входное напряжение регулируется подбором резистора R22 и может быть уложено в стандартные 1 В. Однако следует заметить, что чем выше собственный коф усиления, тем выше уровень THD и вероятность возбуждения. | |
| THD для класса H и выходной мощности 1400 Вт не более THD для класса G и выходной мощности 1400 Вт не более При выходной мощности до включения "второго этажа" питания уровень THD для обоих усилителей не превышает | 0,1 % |
| Рекомендуемый ток покоя препоследнего каскада на резисторе R32 или R35 устанавливается напряжение в 0,2 В резистором R8 | |
| Рекомендуемый ток покоя оконечных транзисторов на любом из резисторов 0,33 Ома устанавливается напряжение в 0, 25 В резистором R29 | |
| Регулировку защиты рекомендуется производить на реальной АС подключив параллельно АС сопротивление 6 Ом и добиваясь устойчивого свечения светодиода VD7 при 75 % от максимальной мощности |
К сожалению у данного усилителя выявился один недостаок - при высоких напряжениях питания дифкаскад начинает смопроизвольно греться из за слишком большого протекающего тока через него. Снизить ток - увеличить искажения, что весьма не желательно. Поэтому было применено использование теплоотводов на транзисторы диф каскада:


ПРОЧИТАТЬ ПОЛНОСТЬЮ ВЕСЬ МАТЕРИАЛ О СЕММЕТРИЧНОМ УСИЛИТЕЛЕСТРОЕНИИ
Сварщик, который подвержен воздействию вредных ультрафиолетовых лучей сварочной дуги, должен позаботиться о своём здоровье, а тем более о сохранности зрения. Стандартные щитки не способны обеспечить таким уровнем защиты, который имеет шлем хамелеон.
Ошибка при выборе маски для сварки хамелеон может привести не только к ожогам лица, но и к потере зрения.
То, что фильтр затемняется, ещё не означает прекращения воздействия вредных лучей. Поэтому на вопрос, как правильно выбрать сварочную маску хамелеон, помогут ответить отзывы сварщиков, которые используют защиту подобного типа длительное время. Как же выбрать маску сварщика хамелеон для комфортной работы?
 В отличие от стандартного щитка, сварочный хамелеон поднял защиту сварщика на новый уровень. Принцип работы такой маски заключается в поляризации жидких кристаллов
. Во время провокации они меняют направление и препятствуют воздействию ультрафиолета. В масках дорогого ценового сегмента используется многослойная защита, это обеспечивает максимально равномерное затемнение. А дополнительный фильтр обеспечивает блокировку инфракрасного излучения.
В отличие от стандартного щитка, сварочный хамелеон поднял защиту сварщика на новый уровень. Принцип работы такой маски заключается в поляризации жидких кристаллов
. Во время провокации они меняют направление и препятствуют воздействию ультрафиолета. В масках дорогого ценового сегмента используется многослойная защита, это обеспечивает максимально равномерное затемнение. А дополнительный фильтр обеспечивает блокировку инфракрасного излучения.
В тело шлема встроены сенсоры, которые улавливают дугу и обеспечивают постоянную защиту глаз. Вся конструкция заключена в блок, который с помощью пластиковых светофильтров защищён с обеих сторон. Можно проводить сопутствующие работы (болгаркой, молотком), не снимая защитного шлема с головы. Пластиковые фильтры со временем требуют замены, так как являются расходным материалом. Ключевой момент защитного процесса - скорость срабатывания светофильтра. Время срабатывания профессиональных моделей - 1 миллисекунда.
 Защитные свойства хамелеона напрямую зависят от температуры окружающей среды. Если температура ниже минус 10 градусов, срабатывание фильтра замедляется. Добросовестные производители указывают предельную рабочую температуру в паспорте изделия. Настройку регулировок можно проводить во время рабочего процесса. Кнопки имеют удобное расположение и легко управляются при тактильном контакте.
Защитные свойства хамелеона напрямую зависят от температуры окружающей среды. Если температура ниже минус 10 градусов, срабатывание фильтра замедляется. Добросовестные производители указывают предельную рабочую температуру в паспорте изделия. Настройку регулировок можно проводить во время рабочего процесса. Кнопки имеют удобное расположение и легко управляются при тактильном контакте.
Важно знать ! Маску необходимо хранить в отапливаемом помещении, в противном случае уменьшается её ресурс.
Классификация фильтров
Светофильтр - это основной элемент шлема хамелеон. Европейский стандарт EN 379 диктует параметры светофильтров согласно регламенту, который обозначает качества через слеш: 1/1/½. Итак, разберём подробно значение каждого пункта маркировки.

Секреты выбора защитной маски
 Шлем хамелеон может комплектоваться фильтрами, а может продаваться и без них.
Шлем хамелеон может комплектоваться фильтрами, а может продаваться и без них.
Согласно нормативно технической документации, материал для изготовления не должен быть проводником тока, быть устойчивым к брызгам метала, а также не допускать проникновения излучения внутрь, тем самым обеспечивать лицо сварщика безопасностью. Таким требованиям соответствует большинство современных масок.
Тело масок отечественного производителя в основном состоит из фибры или пластика. Европейские и Американские образцы отличаются оригинальным дизайном, и могут быть выполнены в виде головы животного. Существует вариант, выполненный из кожи, используются преимущественно в тесных условиях.
Помимо внешнего вида, профессионалы советуют, как выбрать маску хамелеон для сварки по определённым параметрам.

Регулировка крепления маски на голове определяет комфортность использования изделия в дальнейшем. Комфортный угол обзора зависит от близости светофильтра к глазам сварщика. Если принято решение приобретения диоптрических линз, нужно обзавестись фильтром с широким обзорным окном, это избавит от надобности поднимать маску. Проще говоря, обзор сварочного шва можно проводить поверх линзы.
Совет профессионала : Приобретайте только те щитки хамелеон, которые имеют сертификацию и гарантийный срок обслуживания, не покупайте подделки!

Совет профессионала : Светофильтр направлен на работу с аргонно-дуговой сваркой, сможет защитить и от электродуговой сварки, и от работы с полуавтоматикой.
Популярные модели, которые предлагает рынок
 Лидирующими странами по производству масок и фильтров являются Тайвань и Китай. Но иногда их качество изделий оставляет желать лучшего: фильтры работают некорректно, что негативно сказывается на зрении сварщика. Отечественный производитель обеспечивает изделиями достаточного качества, но иногда фильтр некорректно срабатывает при работе с аргонно-дуговой сваркой.
Лидирующими странами по производству масок и фильтров являются Тайвань и Китай. Но иногда их качество изделий оставляет желать лучшего: фильтры работают некорректно, что негативно сказывается на зрении сварщика. Отечественный производитель обеспечивает изделиями достаточного качества, но иногда фильтр некорректно срабатывает при работе с аргонно-дуговой сваркой.
Корейская марка OTOS, иногда поступающая в продажу под брендом из Франции GYSMATIC, имеет слабое место - фильтр. Были случаи расслоения, а также появления пятен и микротрещин.
Маски, которые предлагает Европа, выше в цене, но их качество стабильно высокое. Фильтр одного образца может не подойти к другому изделию. Далее, несколько брендов, которые производят качественные маски, имеющие соответствующий сертификат качества:

Совет профессионала . Если во время сварочных работ возникает дискомфорт в виде жжения, усталости и слезоточивости глаз, нужно отказаться от использования такой маски. Скорее всего, изделие низкого качества.
Теперь вам известны все секреты щитка хамелеон. От качественной защиты зависит не только здоровье глаз сварщика, но и качество текущей работы.
Пантелеев Павел Александрович
В работе даются объяснения возникновения цвета у различных соединений, а также исследуются свойства веществ-хамелеонов.
Скачать:
Предварительный просмотр:
Химия цвета. Вещества-хамелеоны
Секция: естествознание
Выполнил: Пантелеев Павел Николаевич,
Ученик 11 «А» класса
Средней общеобразовательной школы №1148
им. Ф. М. Достоевского
Преподаватель: Кармацкая Любовь Александровна
1. Введение. Стр.2
2. Природа цвета:
2.1. органических веществ; Стр.3
2.2. неорганических веществ. Стр.4
3. Воздействие среды на цвет. Стр.5
4. Вещества-хамелеоны. Стр.7
5. Экспериментальная часть:
5.1. Переход хромата в бихромат и обратно; Стр.8
5.2. Окислительные свойства солей хрома (VI); Стр.9
5.3. Окисление этанола хромовой смесью. Стр.10
6. Фотохромизм. Стр.10
7. Выводы. Стр.13
8.Список использованных источников. Стр.14
1. Введение.
На первый взгляд, может показаться трудным дать объяснение природы цвета. Почему вещества имеют разные цвета? Каким образом цвет вообще возникает?
Интересно, что в глубинах океана обитают существа, в теле которых течёт кровь голубого цвета. Одни из таких представителей – голотурии. При этом кровь рыб, выловленных в море, красная, подобно крови многих других крупных существ.
От чего же зависит цвет различных веществ?
Прежде всего, цвет зависит не только от того, как окрашено вещество, но и от того, как оно освещено. Ведь в темноте всё кажется чёрным. Цвет также определяют химические структуры, преобладающие в веществе: например, цвет листьев растений бывает не только зелёным, но и синим, фиолетовым и др. Это объясняется тем, что в таких растениях помимо хлорофилла, придающего зелёный окрас, преобладают и другие соединения.
Голубая кровь у голотурий объясняется тем, что у них в пигменте, обеспечивающим цвет крови, вместо железа содержится ванадий. Именно его соединения придают голубую окраску жидкости, содержащейся в голотуриях. В глубинах, где они обитают, содержание кислорода в воде очень мало и им приходится приспосабливаться к этим условиям, поэтому в организмах возникли соединения, совершенно иные, чем у обитателей воздушного окружения.
Но мы ещё не ответили на поставленные выше вопросы. В данной работе мы постараемся дать полные, развёрнутые ответы на них. Для этого следует провести ряд исследований.
Целью данной работы и будет дать объяснение возникновения цвета у различных соединений, а также исследовать свойства веществ-хамелеонов.
В соответствии с целью поставлены задачи
Вообще, цвет является результатом взаимодействия света с молекулами вещества. Этот результат объясняется несколькими процессами:
* взаимодействием магнитных колебаний светового луча с молекулами вещества;
* избирательным поглощением тех или иных световых волн молекулами с разными структурами;
* воздействием лучей, отражённых или прошедших через вещество, на сетчатку глаза или на оптический прибор.
Основой для объяснения цвета является состояние электронов в молекуле: их подвижность, способность переходить с одного энергетического уровня на другой, перемещаться от одного атома к другому.
Цвет связан с подвижностью электронов в молекуле вещества и с возможностью перехода электронов на ещё свободные уровни при поглощении энергии кванта света (элементарная частица светового излучения ).
Цвет возникает в результате взаимодействия квантов света с электронами в молекулах вещества. Однако, из-за того, что состояние электронов в атомах металлов и неметаллов, органических и неорганических соединениях различно, механизм появления цвета у веществ также отличается .
2.1 Цвет органических соединений.
У органических веществ , обладающих цветом (а далеко не все они имеют это свойство), молекулы схожи по своей структуре: они, как правило, большие, состоят из десятков атомов. Для возникновения цвета в этом случае значение имеют не электроны отдельных атомов, а состояние системы электронов всей молекулы .
Обычный солнечный свет - это поток электромагнитных волн. Световая волна характеризуется длиной – расстоянием между соседними максимумами или двумя соседними впадинами. Она измеряется в нанометрах (нм). Чем короче волна, тем больше её энергия, и наоборот.
Окраска вещества зависит от того, какие волны (лучи) видимого света оно поглощает. Если солнечный свет веществом совсем не поглощается, а отражается и рассеивается, то вещество будет казаться белым (бесцветным). Если же вещество поглощает все лучи, то оно кажется чёрным.
Процесс поглощения или отражения определённых лучей света связан с особенностями строения молекулы вещества. Поглощение светового потока всегда связано с передачей энергии электронам молекулы вещества. Если в молекуле содержатся s-электроны (образующие сферическое облако ), то для возбуждения их и перевода на другой энергетический уровень требуется большая энергия. Поэтому соединения, имеющие s-электроны, всегда кажутся бесцветными. В то же время p-электроны (образующие облако в форме восьмёрки ) возбуждаются легко, так как связь, осуществляемая ими менее прочная. Такие электроны содержатся в молекулах, имеющих сопряжённые двойные связи. Чем длиннее цепь сопряжения, тем больше p-электронов и тем меньше требуется энергии для их возбуждения. Если энергия волн видимого света (длины волн от 400 до 760 нм) будет достаточной для возбуждения электронов, то появляется окраска, которую мы видим. Лучи, затраченные на возбуждение молекулы, будут ей поглощаться, а непоглощённые будут восприниматься нами как окраска вещества .
2.2 Цвет неорганических веществ.
У неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого. Решающую роль здесь играет внешняя электронная оболочка элемента.
Как и в органических веществах, возникновение цвета здесь связано с поглощением и отражением света.
Вообще, окраска вещества складывается из суммы отражённых волн (или прошедших через вещество без задержки). При этом цвет вещества означает, что из всего диапазона длин волн видимого света им поглощаются определённые кванты. В молекулах окрашенных веществ энергетические уровни электронов расположены близко друг к другу. Например, вещества: водород, фтор, азот – кажутся нам бесцветными. Это происходит из-за того, что кванты видимого света не поглощаются ими, так как не могут перенести электроны на более высокий уровень. То есть, через эти вещества проходят ультрафиолетовые лучи, не воспринимаемые человеческим глазом, поэтому и сами вещества для нас не имеют цвета. У цветных веществ, например, хлора, брома, йода, электронные уровни расположены теснее друг к другу, поэтому кванты света в них способны перевести электроны из одного состояния в другое .
Опыт. Влияние иона металла на окраску соединений.
Приборы и реактивы: четыре пробирки, вода, соли железа(II), кобальта(II), никеля (II), меди (II).
Выполнение опыта. В пробирки наливаем 20-30 мл воды, вносим по 0,2 г солей железа, кобальта, никеля и меди и перемешиваем до растворения. Окраска раствора железа стала жёлтой, кобальта – розовой, никеля - зелёной, а меди – синей.
Вывод: Как известно из химии, структура этих соединений одинакова, однако они имеют различное число d-электронов: у железа – 6, у кобальта – 7, у никеля – 8, у меди – 9. Это число влияет на окраску соединений. Поэтому и видно различие в цвете.
3. Воздействие среды на цвет.
Ионы в растворе окружены оболочкой растворителя. Слой таких молекул, непосредственно примыкающих к иону, называют сольватной оболочкой .
В растворах ионы могут воздействовать не только друг на друга, но и на окружающие их молекулы растворителя, а те в свою очередь на ионы. При растворении и в результате сольватации возникает цвет у иона ранее бесцветного. Замена воды на аммиак углубляет цвет. Аммиачные молекулы деформируются легче и интенсивность окраски усиливается.
Теперь сравним интенсивность окраски соединений меди.
Опыт №3.1. Сравнение интенсивности окраски соединений меди.
Приборы и реактивы: четыре пробирки, 1-процентный раствор CuSO 4, вода, НCl, раствор аммиака NH 3, 10-процентный раствор гексацианоферрата(II) калия.
Выполнение опыта. В одну пробирку помещаем 4 мл CuSO 4 и 30 мл H 2 O, в другие две – 3 мл CuSO 4 и 40 мл H 2 O. Добавляем в первую пробирку 15 мл концентрированной НCl – появляется жёлто-зелёная окраска, во вторую – 5 мл 25-процентного раствора аммиака – появляется синяя окраска, в третью – 2 мл 10-процентного раствора гексацианоферрата(II) калия – наблюдаем красно-бурый осадок. В последнюю пробирку добавляем раствор CuSO 4 и оставляем для контроля.
2+ + 4Cl - ⇌ 2- + 6H 2 O
2+ + 4NH 3 ⇌ 2+ + 6H 2 O
2 2 + 4- ⇌ Cu 2 + 12 H 2 O
Вывод: При уменьшении количества реагента (вещества, участвующего в химической реакции ), необходимого для образования соединения, происходит увеличение интенсивности окраски. При образовании новых соединений меди происходит перенос заряда и изменение цвета.
4. Вещества-хамелеоны.
Понятие «хамелеон» известно, прежде всего, как биологический, зоологический термин, обозначающий пресмыкающееся, обладающее способностью менять окраску своего кожного покрова при раздражении, перемене цвета окружающей среды и т. п.
Однако «хамелеонов» можно встретить и в химии. Так в чём же связь?
Обратимся к химическому понятию:
Вещества-хамелеоны - это вещества, меняющие свою окраску в химических реакциях и свидетельствующие об изменениях в исследуемой среде. Выделяем общее – изменение цвета (окраски). Именно это и связывает данные понятия. Вещества-хамелеоны известны с давних времён. В старинных руководствах по химическому анализу рекомендуется использовать «раствор хамелеона» для определения в образцах неизвестного состава содержания сульфита натрия Na
2
SO
3
, пероксида водорода Н
2
O
2
или щавелевой кислоты Н
2
С
2
O
4
. «Раствор хамелеона» - это раствор перманганата калия КМnO
4
, который при химических реакциях, в зависимости от среды, меняет свою окраску по-разному. Например, в кислотной среде ярко-фиолетовый раствор перманганата калия обесцвечивается из-за того, что из перманганат-иона МnO
4
-
образуется катион, т.е.
положительно заряженный ион
Мn
2+
; в сильнощелочной среде из ярко-фиолетового МnO
4
- получается зелёный манганат-ион МnO
4
2-
. А в нейтральной, слабокислой или слабощелочной среде конечным продуктом реакции будет нерастворимый чёрно-бурый осадок диоксида марганца МnO
2
.
Добавим, что благодаря своим окислительным свойствам, т.е. способности отдавать электроны или забирать их у атомов других элементов, и наглядному изменению окраски в химических реакциях перманганат калия нашел широкое применение в химическом анализе.
Значит, в данном случае «раствор хамелеона» (перманганата калия) используется в качестве индикатора, т.е.
вещества, показывающего наличие химической реакции или изменения, произошедшие в исследуемой среде.
Существуют и другие вещества, называемые «хамелеонами». Мы рассмотрим вещества, содержащие элемент хром Cr.
Хромат калия - неорганическое соединение, соль металла калия и хромовой кислоты с формулой K 2 CrO 4 , жёлтые кристаллы, растворимые в воде.
Бихрома́т ка́лия (двухромовокислый калий, ка́лиевый хро́мпик) - K 2 Cr 2 O 7 . Неорганическое соединение, оранжевые кристаллы, растворимые в воде. Высокотоксичен.
5. Экспериментальная часть.
Опыт №5.1. Переход хромата в бихромат и обратно.
Приборы и реактивы: раствор хромата калия К 2 СrO 4 , раствор бихромата калия К 2 Cr 2 O 7 , серная кислота, гидроксид натрия.
Выполнение опыта. К раствору хромата калия добавляем серную кислоту, в результате происходит изменение окраски раствора из жёлтого в оранжевый цвет.
2К 2 CrO 4 + Н 2 SO 4 = К 2 Cr 2 O 7 + К 2 SO 4 + Н 2 О
К раствору бихромата калия добавляю щёлочь, в результате происходит изменение окраски раствора из оранжевой в жёлтую.
К 2 Cr 2 O 7 + 4NaOH = 2Na 2 CrO 4 + 2КOH + Н 2 О
Вывод: В кислой среде хроматы неустойчивы, ион жёлтого цвета превращается в ион Cr
2
O
7
2-
оранжевого цвета, а в щелочной среде реакция протекает в обратном направлении:
2 Cr
2
O
4
2-
+ 2Н
+
кислая среда
-
щелочная
среда
Cr
2
O
7
2-
+ Н
2
О.
Окислительные свойства солей хрома (VI).
Приборы и реактивы: раствор бихромата калия К 2 Cr 2 O 7 , раствор сульфита натрия Na 2 SO 3 , серная кислота H 2 SO 4 .
Выполнение опыта. К раствору К 2 Cr 2 O 7 , подкисленному серной кислотой, добавляем раствор Na 2 SO 3. Наблюдаем изменение окраски: оранжевый раствор стал зелёно-синим.
Вывод: В кислой среде хром восстанавливается сульфитом натрия от хрома (VI) до хрома (III): К 2 Cr 2 O 7 + 3Na 2 SO 3 + 4H 2 SO 4 = К 2 SO 4 + Cr 2 (SO 4 ) 3 + 3Na 2 SO 4 + 4H 2 O.
Опыт №5.4. Окисление этанола хромовой смесью.
Приборы и реактивы: 5%-ный раствор бихромата калия К 2 Cr 2 O 7 , 20%-ный раствор серной кислоты H 2 SO 4 , этиловый спирт (этанол).
Выполнение опыта: К 2 мл 5%-ного раствора бихромата калия приливаем 1 мл 20%-ного раствора серной кислоты и 0,5 мл этанола. Наблюдаем сильное потемнение раствора. Разбавляем раствор водой, чтобы лучше увидеть его оттенок. Получаем раствор жёлто-зелёного цвета.
К
2
Cr
2
O
7
+ 3C
2
H
5
OH+ H
2
SO
4
→
3CH
3
-CОН + Cr
2
О
3
+ K
2
SO
4
+ 4H
2
O
Вывод: В кислотной среде этиловый спирт окисляется бихроматом калия. При этом образуется альдегид. Этот опыт показывает взаимодействие химических хамелеонов с органическими веществами.
Опыт 5.4. наглядно иллюстрирует принцип, по которому действуют индикаторы для обнаружения алкоголя в организме. Принцип основан на специфическом ферментативном окислении этанола, сопровождающегося образованием пероксида водорода (Н 2 О 2 ), вызывающего образование окрашенного хромогена, т.е. органического вещества, содержащего хромофорную группу (хим. группа, состоящая из атомов углерода, кислорода, азота).
Таким образом, эти индикаторы визуально (по цветовой шкале) показывают содержание алкоголя в слюне человека. Они применяются в медицинских учреждениях, при установлении фактов употребления алкоголя и алкогольного опьянения. Область применения индикаторов – любая ситуация, когда необходимо установить факт употребления алкоголя: проведение предрейсовых осмотров водителей транспортных средств, выявление нетрезвых водителей на автодорогах автоинспекцией, использование при экстренной диагностике, как средство самоконтроля и др.
6. Фотохромизм.
Познакомимся с интересным явлением, где также происходит изменение цвета веществ, фотохромизмом.
Сегодня очками со стеклами-хамелеонами вряд ли кого-то удивишь. Но история открытия необычных веществ, меняющих свой цвет в зависимости от освещенности, очень интересна. В 1881 году английский химик Фипсон получил от своего друга Томаса Гриффита письмо, в котором тот описывал свои необычные наблюдения. Гриффит писал, что входная дверь почты, расположенной напротив его окон, в течение дня меняет свой цвет - темнеет, когда солнце в зените, и светлеет в сумерках. Заинтересовавшись сообщением, Фипсон исследовал литопон - краску, которой была окрашена дверь почты. Наблюдение его друга подтвердилось. Фипсон не смог объяснить причину явления. Однако обратимой цветной реакцией не на шутку заинтересовались многие исследователи. И в начале ХХ века им удалось синтезировать несколько органических веществ, названных "фотохромами", то есть "светочувствительными красками". Со времен Фипсона ученые многое узнали о фотохромах – веществах, меняющих окраску под действием света.
Фотохромизм, или тенебресценция - явление обратимого изменения окраски вещества под действием видимого света, ультрафиолета.
Воздействие света вызывает в фотохромном веществе , атомарные перестройки, изменение заселённости электронных уровней. Параллельно с изменением цвета вещество может менять показатель преломления, растворимость, реакционную способность, электропроводимость, другие химико-физические характеристики. Фотохромизм присущ ограниченному числу органических и неорганических, природных и синтетических соединений.
Различают химический и физический фотохромизм:
- химический фотохромизм: внутримолекулярные и межмолекулярные обратимые фотохимические реакциями (таутомеризация (обратимая изомерия), диссоциация (расщепление), цис-транс-изомеризация и др.);
- физический фотохромизм: результат перехода атомов или молекул в разные состояния. Изменение окраски в этом случае обусловлено изменением заселённости электронных уровней. Такой фотохромизм наблюдается при воздействии на вещество только мощных световых потоков.
Фотохромы в природе:
- Минерал тугтупит способен менять цвет от белого или бледно-розового до ярко-розового.
Фотохромные материалы
Существуют следующие типы фотохромных материалов: жидкие растворы и полимерные плёнки (высокомолекулярные соединения ), содержащие фотохромные органические соединения, стекла с равномерно распределёнными в их объёме микрокристаллами галогенидов серебра (соединения серебра с галогенами ), фотолиз (распад под действием света ) которых обусловливает фотохромизм; кристаллы галогенидов щелочных и щёлочно-земельных металлов, активированные различными добавками (например, CaF 2 /La,Ce; SrTiO 3 /Ni,Mo).
Эти материалы применяются в качестве светофильтров переменной оптической плотности (т. е. регулируют поток света) в средствах защиты глаз и приборов от светового излучения, в лазерной технике и т.д.
Фотохромные линзы
Фотохромная линза на свету, частично прикрытая бумагой. Между светлой и темной частями виден второй уровень цвета, так как фотохромные молекулы расположены на обеих поверхностях линзы поликарбоната и других пластмасс . Фотохромные линзы обычно темнеют в присутствии ультрафиолета и светлеют при его отсутствии меньше чем за минуту, но полный переход из одного состояния в другое происходит от 5 до 15 минут.
Выводы.
Итак, цвет различных соединений зависит:
*от взаимодействия света с молекулами вещества;
*у органических веществ цвет возникает в результате возбуждения электронов элемента и их перехода на другие уровни. Важно состояние системы электронов всей большой молекулы;
*у неорганических веществ цвет обусловлен электронными переходами и переносом заряда от атома одного элемента к атому другого. Большую роль играет внешняя электронная оболочка элемента;
*на окраску соединения влияет внешняя среда;
*важную роль играет число электронов в соединении.
Список использованных источников
1. Артеменко А. И. «Органическая химия и человек» (теоретические основы, углублённый курс). Москва, «Просвещение», 2000.
2. Фадеев Г. Н. «Химия и цвет» (книга для внеклассного чтения). Москва, «Просвещение», 1977.
Сварочные маски типа хамелеон названы так потому, что световой фильтр автоматически меняет степень затемнения в зависимости от интенсивности светового потока. Это намного удобнее, чем обычный щиток или маска старого типа со сменным фильтром. Надев хамелеон, вы хорошо все видите и до начала сварки: фильтр почти прозрачный и не мешает вам работать. При розжиге дуги за считанные доли секунды он затемняется, защищая глаза от ожога. После того как дуга погаснет, он снова становится прозрачным. Вы можете проводить все необходимые манипуляции не снимая маску, что намного удобнее, чем поднимать и опускать защитный экран и уж в разы лучше, чем держать в руке щиток. Но обширный выбор разных по цене экземпляров может поставить в тупик: в чем разница, и какая из них лучше? Как выбрать маску хамелеон расскажем ниже.
Маски для сварки хамелеон представлены в большом разнообразии. Выбор — совсем непростая задача. Причем важен не столько внешний вид, как качественные показатели
Светофильтр в хамелеоне: что такое и какой лучше
То небольшое стекло, которое установлено на сварочной маске является настоящим чудом науки и техники. В нем собраны последние достижения в оптике, микроэлектронике, в области жидких кристаллов и солнечной энергетике. Вот такое «стекло». На самом деле это целый многослойный пирог, который состоит из следующих элементов:

Основное и главное преимущество сварочной маски-хамелеона в том, что даже если она не успела сработать, ультрафиолет и инфракрасное излучение она не пропустит (если маска была опущена). И степень защита от этих вредных воздействий никак не зависит от настроек. В любом случае и при любых настройках от этих типов вредного влияния вы ограждены.
Но это только в том случае, если в «пироге» присутствуют соответствующие фильтры и имеют они надлежащее качество. Так как проверить это без специальных приспособлений невозможно, приходится ориентироваться на сертификаты. А они у масок должны быть обязательно. Причем на территории России их выдавать могут только два центра: ВНИИС и ФГБУ при ВНИИ охраны и экономики труда. Чтобы уж быть точно уверенными в том, что сертификат подлинный, его номер можно на официальном сайте федеральной службы Росаккреддитации вот по этой ссылке.

Это форма на сайте Россаккредитации для проверки сертификата. Заполнить можно только номер, все остальные поля оставив пустыми (Чтобы увеличить размер картинки щелкните по ней правой клавишей мышки)
В соответствующее поле вводится номер сертификата и получаете дату действия, информацию о заявителе, изготовителе. Небольшое примечание: аббревиатура СИЗОД расшифровывается как «средство индивидуальной защиты оптического действия». Так называется маска сварщика на бюрократическом языке.

Если такой сертификат есть, появится такое сообщение. Нажав на ссылку увидите текст сертификата (Чтобы увеличить размер картинки щелкните по ней правой клавишей мышки)
Самое главное, что вы убеждаетесь, что данный продукт (сравните, кстати, и название и модель) является безопасным для вашего здоровья.
Возможно, вас заинтересует,
Классификация автоматических сварочных светофильтров
Так как светофильтр и его качество — ключевой элемент в данном изделии, то и выбор маски хамелеона нужно начинать с него. Все его показатели классифицируются по стандарту EN379 и должны отображаться на его поверхности через дробь.

Теперь подробнее, что скрывается за этими цифрами и какими они должны быть. В каждой из позиций может стоять цифра от 1, 2, 3. Соответственно «1» — самый лучший вариант — первый класс, «3» — самый худший — третий класс. теперь о том, в какой позиции отображается какая характеристика и что она значит.

Расшифровка классификации EN37
Оптический класс
Он отражает, насколько четко и без искажений будет вам видна картинка через светофильтр. Зависит от качества используемого защитного стекла (пленки) и качества сборки. Если на первом месте стоит «1», искажения будут минимальными. Если значения больше, будете все видеть, как через кривое стекло.
Рассеивание света
Зависит от чистоты и качества используемых оптических кристаллов. Показывает, степень «мутности» передаваемой картинки. Сравнить можно с мокрым автомобильным стеклом: пока встречек нет, капли почти не мешают. Как только появляется источник света, все расплывается. Вот чтобы не было этого эффекта, необходимо чтобы на второй позиции была «1».
Однородность или гомогенность
Показывает, насколько равномерно затеняется фильтр в разных частях. Если на третьей позиции стоит единица, разница может быть не более 0,1DIN, 2 — 0,2 DIN, 3 — 0,3 DIN. Понятно, что комфортнее будет при равномерном затемнении.
Угловая зависимость
Отражает зависимость затемнения от угла просмотра. Тут тоже самое лучшее значение «1» — первый класс меняет затемнение не более чем на 1 DIN, второй — на 2 DIN и третий — на 3DIN.

Так выглядит «в живую» разница между качественной маской и с не очень хорошим светофильтром
Из всего этого понятно, что чем больше в характеристике светофильтра единиц, тем комфортнее вам будет работать в маске. Вот на это и нужно ориентироваться при выборе маски сварщика хамелеон. Профессионалы предпочитают как минимум такие параметры 1/1/1/2. Стоят такие маски дорого, но даже при длительной работе в них не устают глаза.
Сварщикам-любителям, для работы время от времени, можно обойтись светофильтрами попроще, но 3-й класс считается «прошлым веком». Потому наверное, покупать маски с такими фильтрами не стоит.
И еще один момент. Продавцы всю эту классификацию называют обычно одним термином «Оптический класс». Просто эта формулировка достаточно точно отражает суть всех характеристик.

Есть еще несколько настроек хамелеона, которые позволяют подстроить режим затемнения для данной ситуации. Они могут располагаться внутри, на светофильтре, а могут быть вынесены наружу в виде ручек слева на боковой поверхности маски. Это следующие параметры:

Маска хамелеон как выбрать
Кроме параметров светофильтра есть еще масса других настроек и особенностей, которые могут повлиять на выбор.
- Количество датчиков обнаружения дуги. Их может быть 2, 3 или 4. Они реагируют на появление дуги. Визуально их можно увидеть на лицевой панели маски. Это небольшие круглые или квадратные «окошки» на поверхности фильтра. Для любительского использования достаточно 2-х штук, для профессионалов — чем больше, тем лучше: если какие-то окажутся заблокированными (перекроются каким-нибудь предметом при сварке в сложной позиции), то среагируют остальные.

- Скорость срабатывания светофильтра. Разброс параметров тут большой — от десятков до сотен микросекунд. Выбирая маску для домашней сварки, бурите ту, хамелеон которой затемнится не позднее чем через 100 микросекунд. Для профессионалов время меньше: 50 микросекунд. Световые удары мы порой не замечаем, но их результат — уставшие глаза, а профессионалам они нужны весь рабочий день. Так что требования жестче.
- Размеры фильтра. Чем больше стекло, тем больший обзор вы получаете. Но размеры светофильтра сильно отражаются на стоимости маски.
- Плавная или ступенчатая регулировка степени затемнения. Лучше — плавная. Если затемнятся/просветляться фильтр будет скачками, вы быстро устанете. К тому же он моет начать «моргать» от бликов, что не обрадует.
- Исходная степень затемнения и диапазон регулировки. Чем светлее фильтр в исходном состоянии, тем лучше вам будет видно до начала сварки. Также желательно чтобы было два диапазона затемнения: до небольших степеней до 8DIN при работе с аргоном или при ручной дуговой сварке при плохой освещенности. Также меньшее затемнение может понадобиться человеку в возрасте. и при хорошем освещении необходимо затемнение до 13 DIN. Так что лучше, если есть два режима: 5-8DIN/8-13DIN.
- Электропитание. На большинстве масок для сварки с автоматическим затемнением есть два типа питающих элементов: солнечная батарея и литиевые батарейки. Такой комбинированный источник питания является наиболее надежным. Но при этом отсек литиевых батарей должен открываться, чтобы была возможность замены вышедших из строя батарей. В некоторых дешевых масках батарейки интегрированные: вынуть их можно только разрезав пластик (что иногда наши умельцы делают).

- Вес. Маски могут весить от 0,8 кг до 3 кг. Если придется носить на голове трехкилограммовую гирю часов семь-восемь, к концу смены шея, да и голова будут как деревянные. Для любительской сварки этот параметр не очень критичен, хотя тоже совсем не комфортно работать в тяжелой маске.
- Удобство крепления на голове. Есть две системы крепления оголовья и самого щитка, но для данных масок они почти неважны: вам же не нужно каждый раз поднимать/опускать маску. Она может быть опущена на протяжении всей работы. Важно то, сколько есть регулировок и насколько плотно они позволяют подогнать оголовье. Также важно, чтобы все эти ремешки не давили, не терли, чтобы сварщику было комфортно.
- Наличие регулировки, позволяющей отодвинуть щиток от лица. Это важно, если вам необходимы для нормального зрения очки. Тогда щиток нужно отнести подальше от лица, чтобы поместились ваши линзы.
Из полезных, но необязательных режимов есть еще возможность переключения маки из режима сварки в режим шлифовки. Этим переключателем вы фактически отключаете питание светофильтра, ваша маска становится обычным щитком.
Марки и производители
Как выбрать маску хамелеон для сварки вы знаете, но как ориентироваться среди массы производителей? В действительности все не очень сложно. Есть проверенные брэнды, которые поставляют всегда качественную продукцию и подтверждают свои гарантийные обязательства. Вот их не очень много:

- SPEEDGLAS из Швеции;
- OPTREL из Швейцарии;
- BALDER из Словени;
- OTOS из Южной Кореи;
- TECMEN из Китая (не удивляйтесь, маски действительно хорошие).
Для домашнего применения выбрать маску хамелеон непросто. С одной стороны, нужно чтобы она была качественная, но платить 15-20 тысяч за нее явно не всем по карману, да и не рентабельно это. Потому о европейских производителях придется забыть. Они хоть выпускают хорошие маски, но цены на них никак не меньше 70$.
На рынке есть множество китайских масок очень небольшой стоимости. Но их покупать рискованно. Если вам нужен проверенный китайский бренд, это TECMEN (Текмен). Вот у них действительно сертифицированные маски хамелеоны заводского качества. Модельный ряд достаточно широкий, цены — от 3 тыс. рублей до 13 тыс. рублей. Есть со светофильтрами первого класса (1/1/1/2) и чуть хуже, со всеми настройками и регулировками. После обновления даже самая дешевая маска за 3000 рублей (TECMEN DF-715S 9-13 TM8) имеет сменную батарею, задержку просветления от 0,1 до 1 сек, плавную регулировку и режим работы «шлифовка». На фото ниже представлены ее технические характеристики. Трудно поверить, но она стоит всего 2990 рублей.
Неплохо отзываются владельцы о сварочных масках Ресанта. Моделей не очень много, но МС-1, МС-2 и МС-3 — неплохой выбор за небольшие деньги (от 2 тыс. рублей до 3 тыс. рублей).

Маски Ресанта МС-1 и МС-3 имеют плавную регулировку, что несомненно, удобнее. Но в хамелеона МС-1 нет регулировок чувствительности. Профессионалов они вряд ли устроят, а для домашнего использования вполне подходят.

Технические характеристики масок хамелеон Ресанта
Очень неплохие маски выпускает Южно-Корейская фирма OTOS (Отос). У нее цены чуть выше, чем у приведенных выше, но есть две относительно недорогие модели: OTOS MACH II (W-21VW) за 8700 рублей и ACE-W i45gw (Infotrack™) за 13690 рублей.

Технические характеристики OTOS MACH II W-21VW эта маска-хамелеон — достойный выбор даже для профессионального использования
Эксплуатация сварочного хамелеона
Основное требование к уходу за маской: светофильтр нужно беречь: он легко царапается. Потому класть маску «лицом» вниз нельзя. Протирать ее нужно только абсолютно чистой и мягкой тканью. Если нужно — можно смочить ткань чистой водой. НЕ протирать ни спиртом, ни какими-либо растворителями: светофильтр покрыт защитной пленкой, которая растворяется в этих жидкостях.
Есть еще одна особенность любых сварочных хамелеонов: они при низких температурах начинают «тормозить». То есть срабатывают с задержкой, причем в обе стороны — и на затемнение, и на просветление. Особенность очень неприятная, так что нормально работать в них зимой не получится даже если указана температура эксплуатации от -10°C, как на TECMEN DF-715S 9-13 TM8. Уже при -5° все не могут вовремя затемниться. Так что в этом плане честнее оказался OTOS, указав стартовую температуру эксплуатации от -5°C.
Напоследок посмотрите видео о том, как выбрать маску хамелеон для сварки.
















 Назад
Вперёд
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели урока:
- повторить алгоритм по составлению ОВР методом электронного баланса и раскрыть сущность метода полу реакций МПР.
- показать преимущества в формировании умений прогнозирования направления протекания ОВР в растворах на примере соединений марганца.
- закрепить умения по составлению уравнений ОВР, протекающих в различных средах.
- научить применять полученные знания для решения конкретных задач.
Задачи урока.
- Подготовить учащихся к выполнению задания 36 из ЕГЭ по химии
- Планируемый результат
Предметные:
- знать ОВР, правила составления ОВР;
- уметь Определять характер среды, условия протекания ОВР, исходные и продукты образования, окислителя и восстановителя, составить электронный баланс и пользоваться методом полу реакций, проводить эксперимент и на основе эксперимента сделать вывод.
Метапредметные:
- уметь Организовывать свою деятельность, определять ее цели и задачи, выбирать средства реализации цели и применять их на практике, оценивать результаты; устанавливать причинно-следственные связи, строить логические рассуждения, делать выводы; умение создавать модели и схемы; умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками, работать индивидуально и в группе.
Личностные: Формирование ответственного отношения к учению, готовности и способности обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию; формирование коммуникативной компетентности в общении и сотрудничестве со сверстниками в процессе учебной деятельности.
Оборудование и реактивы:
- персональный компьютер, проектор, презентация
- Раствор перманганата калия, кристаллический перманганат калия, раствор серной кислоты, раствор щелочи, раствор иодида калия, сульфит натрия, 5-10%-ный раствор пероксида водорода
- Большие пробирки, помещенных в демонстрационный штатив с белым фоном, прибор для получения газов, колба-приемник, железный штатив, спиртовка, лучинка, спички, пробирки в универсальном штативе на каждом столе, стеклянная палочка
- Приложение 1 “Соединения элемента марганца: окислители и восстановители, расчет степеней окисления”
- Приложение 2 “Алгоритм составления уравнений ОВР методом электронного баланса”
- Приложение 3 “Алгоритм составления уравнений ОВР ионно-электронным методом”
- Приложение 4 “Окислительные и восстановительные свойства пероксида водорода в зависимости от характера среды. Инструкция по выполнению лабораторного опыта”.
Тип урока: усвоение новых знаний с применением имеющихся знаний и умений с последующим обобщением и систематизацией.
Формы, применяемые на уроке
- Разъяснение (объяснительно-иллюстративный)
- рассуждение (частично-поисковый)
- общая характеристика (проблемный)
Методы, применяемые на уроке
- словесные (беседа, объяснение)
- наглядные (опыты, компьютерная презентация, информационные приложения)
- практические (демонстрация и самостоятельное выполнение опытов).
План урока.
- Актуализация знаний.
- Повторение основных теоретических понятий темы.
- Определение, среды (кислой, нейтральной или щелочной), в которой протекает реакция.
- Электронный и ионно-электронный метод составления уравнений ОВР
- Закрепление полученных знаний
Ход урока
1. Актуализация знаний.
Подготовка к выполнению задания 36 состоит из нескольких элементов:
Изучение теоретического материала, индивидуальные консультации с преподавателем и выполнение заданий, основываясь на данном методическому материале.
Прежде чем приступить к выполнению работы необходимо освоить основные термины, определения, понятия и овладеть техникой химических расчетов.
В задании предложена схема реакции, причем формулы одного-двух веществ заменены многоточиями.
Все задания 36 можно условно разделить на три типа:
Учитель проецирует с помощью видеопроектора схемы на экран Слайд 2
2. Повторение пройденного материала
В программе основной школы вы уже затрагивали основные вопросы, необходимые для выполнения задания 36.
Знаете, какие химические реакции относятся к окислительно -восстановительным и что в ОВР один из участников окисляется. Это восстановитель, т.е. он отдает электроны и повышает свою степень окисления. Другой – восстанавливается. Это окислитель, т.е. он оттягивает на себя валентную пару электронов, понижает свою степень окисления.
Слайд 3 Учитель проецирует с помощью видеопроектора схемы на экран
Выполняем задание. Учащиеся имеют приложение на партах Приложение 1
Выполняем упражнение:
- определение степени окисления элементов по формуле
- строение атома марганца, определяют возможные степени окисления элемента, его окислительную и восстановительную способность.
- заполняют таблицу по типам химических реакций
- формируют вывод
Учащиеся заполняют таблицу. Делают вывод: все реакции замещения и реакции, в которых присутствуют простые вещества относятся к ОВР. Рассматривают строение атома марганца. Делают вывод.
3. Определение, среды (кислой, нейтральной или щелочной), в которой протекает реакция.
Приступая к выполнению данного задания, вы, логически рассуждая, должны определить пропущенные вещества. Для этого необходимо знать основные окислители и восстановители, а также продукты их восстановления или окисления.
Кроме того, для того, чтобы дописать пропущенные вещества, следует учитывать, в какой среде протекает окислительно - восстановительная реакция.
Определить среду можно
А) по продуктам восстановления окислителя (например, марганца)
Перманганаты – сильные окислители, при чём, в зависимости от рН среды:
Учитель проецирует с помощью видеопроектора схемы на экран, проводит опыт
Слайд 4, 5, 6 Демонстрационный опыт “Химический хамелеон”
Восстановление перманганата калия сульфитом натрия в различных средах.
4. Процедуры подбора коэффициентов в уравнениях
Что касается собственно процедуры подбора коэффициентов в уравнениях, то можно использовать метод электронного баланса, а для реакций в растворах удобен так называемый метод полу реакций, или электронно-ионный.
Учитель проецирует с помощью видеопроектора схемы на экран Слайд 7,8,9
Составление уравнений ОВР методом электронного баланса
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. Этим методом вы уже пользовались при работе на уроках в 8-9 классах.
Приложение 2.
Работа у доски: Уровнять реакции, используя метод электронного баланса, определить окислитель и восстановитель. Слайд 7,8,9
Делают вывод: Методом электронного баланса расставлять коэффициенты удобно, если известны исходные вещества и продукты реакции, т.е. даны полные схемы реакций.
Метод полу реакций, или электронно-ионный.
При использовании метода полу реакций (электронно-ионный баланс) следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходит по-разному в кислой, нейтральной и щелочной средах.
Учитель проецирует с помощью видеопроектора схемы на экран. Выполняет опыты.
Учащиеся имеют приложения на партах. Приложение 3. Слайд 10,11
Демонстрационный опыт. Восстановление перманганата калия йодидом калия в различных средах. “Химический хамелеон”
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах
Работа у доски: Уровнять реакции, используя МПР, определить окислитель и восстановитель.
Одну реакцию выполняет учитель, две оставляет на самостоятельную работу учащихся.
Слайд 12,13,14
Делаем вывод:
Рассмотрев метод электронно-ионного баланса
или метод полу реакций можно выделить следующие
достоинства данного метода:
5. Закрепление полученных знаний
Реакции – диспропорционирования.
Учитель проецирует с помощью видеопроектора схемы на экран. Выполняет опыт.
Демонстрационный опыт “Химический хамелеон” Слайд 15, 16
Описание:
Для опыта нужна пробирка с газоотводной трубкой. В пробирку насыпали кристаллический перманганат калия (марганцовку). При нагревании перманганат калия разлагается, выделяющийся кислород поступает по газоотводной трубке в колбу-приемник. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Если опустить тлеющую лучину в колбу с собранным кислородом, то она ярко вспыхнет, т.к. кислород поддерживает горение.
Уравнение проведенной реакции:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2
После окончания опыта и охлаждения пробирки в нее наливают несколько миллилитров воды, тщательно взбалтывают содержимое и наблюдают цвет образовавшихся веществ (К 2 МnO 4 - зеленого цвета и МnO 2 темно-бурого).
K 2 Mn +6 O 4 + H 2 O -> KMn +7 O 4 + Mn +4 O 2 + KOH
При сильном разбавлении водой происходит реакция самоокисления-самовосстановления. Окраска изменится с зеленой на красно-фиолетовую и выпадет бурый осадок.
Самостоятельная работа в тетрадях: Уровнять реакции, используя МПР, определить окислитель и восстановитель. Слайд 15,16
Формируют вывод: Это реакции, где окислитель и восстановитель – один и тот же элемент, входящий в состав одной молекулы.
Самостоятельно проводим опыт и пишем уравнение методом полуреакций
Учитель объясняет, что пероксид водорода может проявлять окислительные и восстановительные свойства, как в кислотной, так и в щелочной среде.
(перекиси могут быть как окислителями, так и восстановителями, электроны перекисей могут переходить от одной молекулы к другой:
Н 2 O 2 + Н 2 O 2 = O 2 + 2Н 2 O.)
Учащиеся выполняют лабораторный опыт и делают вывод о проявлении перекиси водорода окислительных и восстановительных свойств в зависимости от среды.
Примечание. Для эксперимента используют 3%-й раствор перекиси водорода, который можно приобрести в аптеке, как и раствор марганцовки.
Техника эксперимента проста и не требует большой затраты времени.
Учитель проецирует с помощью видеопроектора схемы на экран. Для удобства учащиеся имеют приложение на партах. Приложение 4. Слайд 17
Лабораторная работа: “Восстановление перманганата пероксидом водорода” “Химический хамелеон” - Превращение малинового раствора в бесцветный”
Делают вывод: В этом случае пероксид водорода проявляет восстановительные свойства, а перманганат калия - окислительные.
6. Домашнее задание: Слайд 18